过程工程所在真核细胞N-糖基化修饰基础研究方面取得进展
糖基化作为重要蛋白质修饰,由细胞内多种糖基转移酶的催化介导,对调节蛋白质的结构与功能发挥着至关重要的作用。N-糖基化与代谢异常疾病和癌症的发展、转移有着紧密联系,并影响抗体药物的稳定性、生物活性及免疫反应等。过程工程所化学生物工程前沿交叉研究部高晓冬研究员团队开发了一种对N-糖基化过程中Man5GlcNAc2-PP-Dol(M5GN2-PP-Dol)糖脂中间体转运的体外检测方法,成功证实了转运蛋白Rft1催化M5GN2-PP-Dol跨膜脂质双层的转运活性,可为后续的基因治疗提供靶点。相关研究成果于6月17日发表在Nature Communications上(DOI: 10.1038/s41467-024-48999-3)。
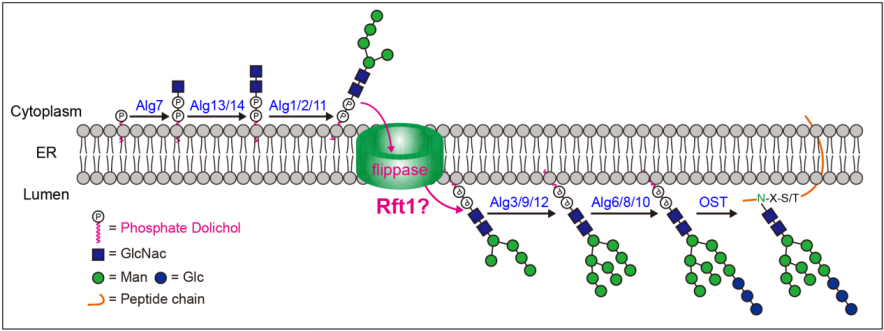
图 内质网膜上多萜醇寡糖前体的装配
M5GN2-PP-Dol的翻转是糖基化能否实现的重要环节,翻转酶可用于蛋白糖基化修饰的工具。人体内糖基化修饰过程中,相关基因突变会引起先天性糖基化障碍(CDG)等糖基化代谢异常的相关疾病,严重威胁人体健康,其中因Rft1基因突变导致的Rft1-CDG疾病的发病机制尚未探明。明确Rft1蛋白的功能和作用机制,将为相关CDG疾病的诊断和靶向治疗提供理论基础。目前,因缺少广泛认可的Rft1活性检测手段,导致Rft1是否为真核细胞M5GN2-PP-Dol翻转酶的争议已持续多年。
为进一步证实这一问题,需要开发更加直接、精准且高效的翻转酶检测体系。研究人员创新性开发了基于甘露糖苷酶结合超高效液相色谱-质谱(UPLC-MS)定量检测技术的体外翻转酶活性检测体系。利用该活性检测体系,证明表达纯化的重组Rft1蛋白可以催化M5GN2-PP-Dol跨脂质双分子层的转运。同时,蛋白的细胞内定位,底物选择性以及RFT1基因敲除细胞表型等研究结果也一致表明Rft1是真核细胞M5GN2-PP-Dol的翻转酶。开发的体外活性检测体系,也为其他转运蛋白的活性研究提供了新的方法。同时考虑到Rft1在真核生物N-糖基化过程在中发挥重要作用,未来的研究将着重于进一步探索Rft1在N-糖基化遗传性疾病和代谢性疾病中的作用机制,为相关疾病的诊断和治疗提供线索。
该工作得到了国家自然科学基金(31971216,32271342)、轻工业技术与工程国家一级学科计划(LITE2018-015)、山东省重大科技创新项目(2019JZZY011006)等的支持。
论文链接:https://doi.org/10.1038/s41467-024-48999-3
(化学生物工程前沿交叉研究部)
