过程工程所揭示“界面机械力”可精准调控免疫系统
常用的疫苗佐剂主要通过分子结合与生化刺激激活免疫系统,这使老年人或免疫低响应人群的免疫激活受限。如何让佐剂对免疫细胞可以进行化学及物理双重刺激?中国科学院院士马光辉、过程工程所夏宇飞研究员团队发现只需重新设计铝佐剂,利用Pickering乳液平台使其构筑出“可变形”的三维机械界面,就可以让树突状细胞(DC)主动感知到机械刺激,从而成倍提升免疫反应的效率。这项工作提供了全新的佐剂设计思路,并为免疫治疗中“力学–生化双重调控”开辟了新路径。相关工作发表于12月10日发表在Cell Biomaterials(DOI: 10.1016/j.celbio.2025.100281)。
在疫苗与免疫治疗飞速发展的今天,人们往往将注意力集中于分子配方、递送系统或新型免疫刺激剂的设计。铝盐、脂质体、MF59等目前临床常用的佐剂,在细胞膜表面的接触面积有限,难以在三维界面上触发机械感受器,然而PIEZO1离子通道等许多模式识别受体对力学变化高度敏感,传统佐剂几乎无法有效调动这些通路,导致免疫激活存在“天花板效应”。
针对这一难题,研究团队通过调控铝盐的晶体结构,将其从传统颗粒转化为稳定于油/水界面的Pickering乳滴外壳(ASPE),构建了“可变形的三维机械界面”。发生形变的乳滴像“气垫”一样贴附在DC表面,增大了与细胞膜的接触面积,有效增强机械刺激信号。调控后的晶体结构,可精准控制界面刚度,晶型越高,界面越“硬”,对细胞施加的机械应力越显著。研究人员发现,强机械刺激可直接激活PIEZO1受体,进而引发Ca2+流入信号链放大,并显著促进抗原交叉递呈。这意味着,佐剂不再只是“携带刺激物的载体”,而成为了主动调控免疫细胞行为的机械工具。
研究团队进一步将临床常用的TLR4激动剂MPLA集成入该平台,形成组装MPLA的ASPE佐剂(ASPE-M),实现机械与生化双通路协同。与目前临床使用的佐剂Alum+MPLA(AS04)相比,ASPE-M显著增强了DC的MHCI表达、IL-12/TNF-α分泌与 CD8+ T细胞扩增能力;在带状疱疹(VZV)疫苗模拟体系中表现出更强的Th1偏向免疫,尤其在免疫衰老小鼠模型中,ASPE-M依然能保持高水平的IFN-γ反应与记忆T细胞建立能力;在黑色素瘤(DC)疫苗小鼠治疗模型中,效果提升超过2倍,联合PD-1抑制剂后,肿瘤生长被显著抑制,小鼠生存期明显延长。
此次发现证明了界面力学是免疫调控的重要维度,可与传统生化信号并行甚至互补。通过调控界面结构、应力分布及信号通路耦合,不仅能增强VZV等预防性疫苗效果,对DC疫苗、肿瘤免疫治疗在小鼠模型上也效果显著,有望为老年人、免疫功能低下等难以应答的人群提供更安全、更高效的免疫策略。
过程工程所博士生明亚莉为论文第一作者,夏宇飞为通讯作者,过程工程所硕士生魏锦骥、博士生翟昭仪和郑州大学第一附属医院孟子丰等为论文做出了贡献。
论文链接:https://www.sciencedirect.com/science/article/pii/S3050562325002727?via%3Dihub
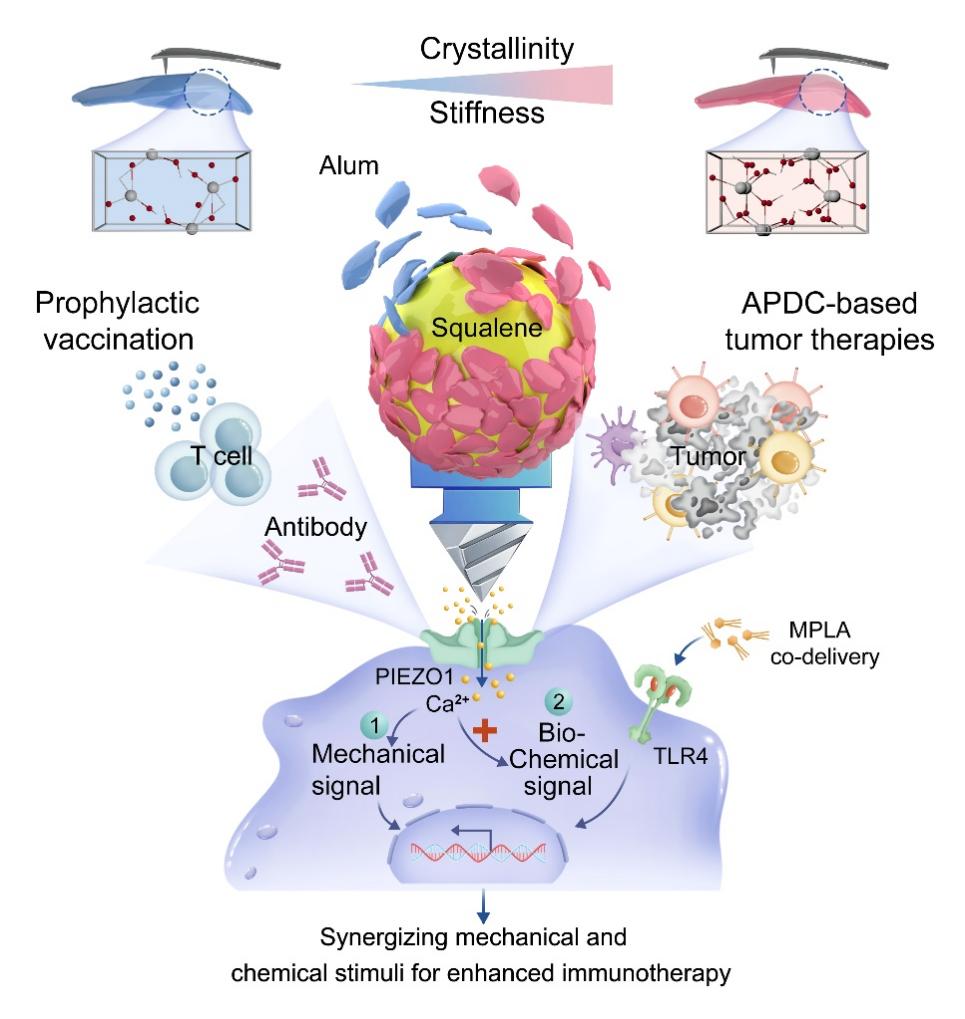
图 铝稳定 Pickering 乳液(ASPE)介导的界面力学生化协同免疫激活
(生物剂型与生物材料研究部)
