过程工程所在溶酶体“陷阱”创制及其病毒清除方面取得新进展
当前的病毒治疗药物存在因病毒变异导致效果欠佳的风险。近日,过程工程所生物药制备与递送重点实验室受病毒入胞感染和胞内病毒清除现象启发,设计并创建了溶酶体“陷阱”(lysoTRAP)新策略。该lysoTRAP能高效捕获、内化和降解病毒,在细胞、小鼠、仓鼠和人源肺类器官上,对新冠病毒、流感病毒及其变异株均取得了优异的病毒清除效果。相关工作于11月23日发表在Nature Communications(DOI:10.1038/s41467-024-54505-6)。
用于治疗病毒的药物目前主要包括抗体和小分子抑制剂,其治疗效果高度依赖与病毒蛋白的结合。然而许多病毒容易发生变异,进而导致病毒蛋白结构发生变化,削减了抗体、小分子抑制剂与病毒蛋白的亲和力,致使病毒耐药甚至药物失效。因此,亟待开发一种不受病毒变异影响的抗病毒治疗新策略。
针对上述难题,中国科学院院士、过程工程所研究员马光辉和生物药制备与递送重点实验室主任魏炜基于多年仿生剂型工程研究基础,提出了新型的溶酶体“陷阱”的病毒清除策略。研究团队在巨噬细胞溶酶体表面化学修饰上新冠病毒受体血管紧张素转化酶2(ACE2),以此构建了针对新冠病毒的溶酶体“陷阱”,其能通过表面修饰的ACE2蛋白特异性捕获和内化新冠病毒,隔绝病毒与宿主细胞的接触,随后利用溶酶体内部含有的多种水解酶降解新冠病毒,进一步彻底阻断病毒感染。
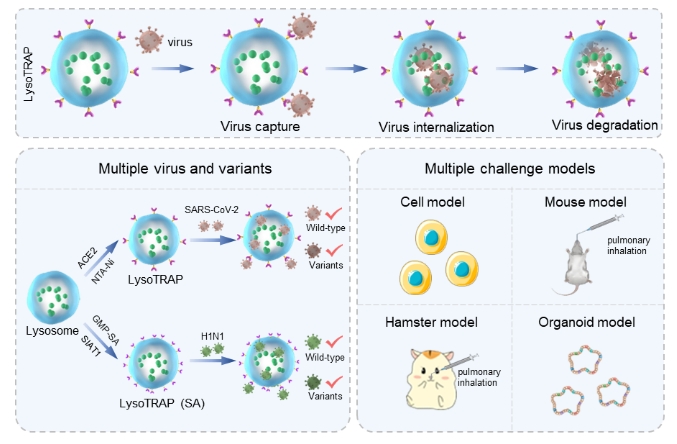
图 溶酶体“陷阱”的病毒清除机理
在细胞和动物模型上,溶酶体“陷阱”对于新冠假病毒及其变异株均展现了极佳的抗病毒感染效果。研究团队还基于新冠真病毒构建了仓鼠攻毒模型,发现溶酶体“陷阱”能够显著降低仓鼠肺部的新冠病毒野生株和奥密克戎株的病毒载量,缓解肺部炎症。此外,研究团队还构建了更贴近临床的人源肺类器官模型,在该模型上证明了溶酶体“陷阱”对于新冠病毒野生株和奥密克戎株均能保持很好的疗效,显著优于传统抗体和小分子抑制剂抗病毒治疗策略。这是因为新冠病毒表面蛋白变异后仍需要和宿主细胞表面受体结合入胞。因此,溶酶体“陷阱”能够不受病毒变异干扰,利用表面的ACE2当作病毒诱饵,诱捕新冠病毒进入溶酶体中发生降解。
研究团队将ACE2受体更换成唾液酸糖受体,构建了针对流感病毒的溶酶体“陷阱”。该溶酶体“陷阱”在细胞、小鼠、类器官多个模型上均取得了优异的流感病毒清除效果,证明了溶酶体“陷阱”平台设计和应用的可拓展性。
上述成果仍属于临床前研究阶段,实际临床疗效有待进一步验证。鉴于该体系构建的通用性、灵活性和安全性,在未来应对病毒性传染病时,有望通过更换溶酶体“陷阱”上的病毒受体,快速构建病毒特异的清除制剂,为传染病的及时和高效防治贡献力量。
近年来,过程工程所生物药制备与递送重点实验室马光辉院士团队的研究员魏炜创制了一系列仿生剂型,在动物模型上成功应用于肿瘤、传染病和炎症性疾病的防治,并且部分剂型已通过医院伦理批准进入个体化临床研究。相关工作相继发表于Nature 2023, 624, 630、Nat Nanotechnol 2023, 18, 933、Nat Nanotechnol 2021, 16, 1413、Cell Host & Microbe 2024, 32, 1502、Sci Transl Med 2021, 13, eabb6981、Nat Biomed Eng 2023, doi.org/10.1038/s41551-023-01112-3、Nat Biomed Eng 2021, 5, 414、Nat Biomed Eng 2021, 5, 968、Nat Commun 2023, 14, 8398、Nat Commun 2023, 14, 4505、Nat Commun 2022, 13, 4214、Nat Commun 2021, 12, 6399、Nat Commun 2019, 10, 5165、Nat Commun 2017, 8, 14537、Sci Adv 2021, 7, eabd7614、Sci Adv 2021, 7, eaba2458、Sci Adv 2020, 6, eaay7735、Sci Adv 2019, 5, eaaw3192等期刊上。
过程工程所博士后吕程亮和博士研究生胡校铭为该论文的共同第一作者,魏炜和马光辉为该论文的共同通讯作者。该工作得到了国家重点研发计划、国家自然科学基金、北京自然科学基金、中国科学院稳定支持基础研究领域青年团队计划和中国医学科学院医学科学创新基金的支持。
论文链接:https://www.nature.com/articles/s41467-024-54505-6
(生物剂型与生物材料研究部)
