过程工程所在工程化益生菌制剂治疗溃疡性结肠炎方面取得新进展
溃疡性结肠炎(Ulcerative colitis, UC)是一种伴有长期炎症和肠道菌群失衡的炎症性肠病,临床现有非甾体抗炎药物以及激素药物疗效欠佳或副作用大。近日,过程工程所生物药制备与递送重点实验室基于数据挖掘和临床发现,设计并创建了嵌合硒点的工程化益生菌制剂,通过协同恢复肠道菌群稳态和氧化还原稳态,实现了安全高效的UC治疗。相关工作于8月27日发表在Cell Host & Microbe (DOI: 10.1016/j.chom.2024.07.028)。
鉴于菌群失衡可能加剧肠道炎症反应,补充益生菌已成为缓解UC症状和恢复肠道微生态平衡的重要策略。然而,益生菌口服后出现的胃酸耐受性差、肠道黏附性差等问题,导致肠道中补充的益生菌数量和存活率非常低。此外,结肠病灶部位的病理微环境复杂,存在着诸多其他致病因素。
面对以上挑战,过程工程所生物药制备与递送重点实验室马光辉院士和魏炜研究员团队基于多年的生物剂型工程研究基础,提出了崭新的益生菌治疗策略。研究团队首先利用机器学习揭示了UC患者中乳杆菌属在众多缺失益生菌中权重最高,同时基于生物信息学发现病灶部位氧化应激的升高覆盖所有细胞类型。进一步与北京大学第一医院崔一民教授团队展开交叉合作,收集的临床样本证实了上述结果,并发现了乳杆菌属丰度、活性氧(ROS)水平与炎症严重程度之间存在明显的相关性。
上述结果表明,UC的治疗需要同时考虑补充活性乳杆菌和高效清除ROS。因此,研究团队提出了干酪乳杆菌和高活性硒共递送的策略。首先在干酪乳杆菌(Lac)上诱导形成细菌周被膜(pericellular film),借助其内部多糖网络的空间限域结晶作用,研究人员实现了在细菌表面成功嵌合超小尺寸的硒点(Se-fLac),硒点的活性远高于传统方法合成的硒纳米颗粒。口服后,Se-fLac有效地增强了Lac的胃酸耐受和肠道黏附。在病灶部位,硒点高效清除活性氧自由基,而Lac调节失衡肠道菌群,实现肠道氧化还原稳态和菌群稳态的恢复,且这两个方面具有相互促进作用,以此协同增强治疗效果。
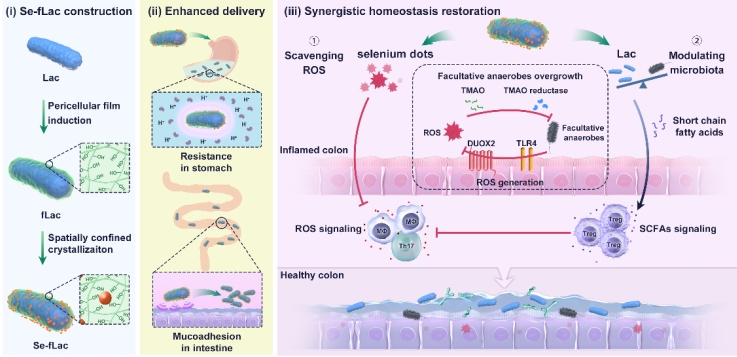
图1. Se-fLac的制备、增强口服递送和协同稳态恢复的示意图
鉴于临床UC发病情况的复杂性,研究人员构建了多种小鼠模型,通过结肠长度、炎症细胞比例、炎症因子水平等多维度证明了Se-fLac能够显著改善UC的症状,且治疗效果远优于临床药物(氨基水杨酸,地塞米松等)。此外,研究人员还构建了更贴近临床的食蟹猴UC模型,Se-fLac治疗后恢复了肠道氧化还原稳态和菌群稳态,炎症水平、肠腔出血和肠壁变厚得到明显改善。
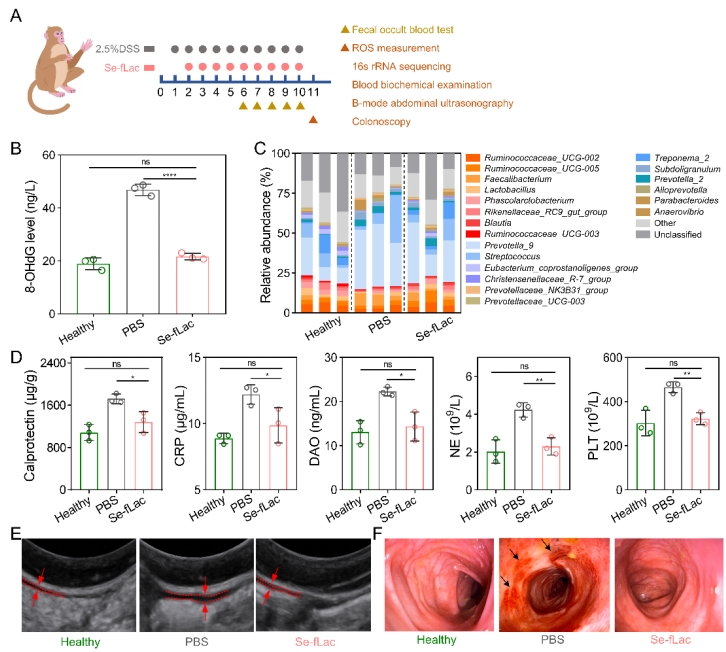
图2. Se-fLac在食蟹猴UC模型中的治疗效果。(A) UC模型建立、治疗和评估的实验设计; (B) 8-OHdG含量的测量; (C) 肠道菌群相对丰度的百分比; (D) 血液和粪便样本中多种炎症相关指标的检测; (E) 腹部B超粘膜层厚度的测量; (F) 显示粘膜层溃疡和出血的结肠镜图像
据研究人员介绍,上述成果仍处于动物水平的临床前研究阶段,实际临床疗效有待进一步研究。鉴于Se-fLac仅包含FDA批准的可口服成分干酪乳杆菌和硒,并且在小鼠和食蟹猴模型中确认了安全性和有效性,该创新剂型具有较大的临床转化潜力。
近年来,过程工程所生物药制备与递送重点实验室马光辉院士团队魏炜研究员创制了一系列药物和疫苗递送新剂型,在动物模型上成功用于肿瘤、传染病和炎症性疾病的防治,并且部分剂型已通过医院伦理批准进入个体化临床研究。相关工作相继发表于Nature 2023, 624, 630、Nat Nanotechnol 2023, 18, 933、Nat Nanotechnol 2021, 16, 1413、Sci Transl Med 2021, 13, eabb6981、Nat Biomed Eng 2023, doi.org/10.1038/s41551-023-01112-3、Nat Biomed Eng 2021, 5, 414、Nat Biomed Eng 2021, 5, 968、Sci Adv 2021, 7, eabd7614、Sci Adv 2021, 7, eaba2458、Sci Adv 2020, 6, eaay7735、Sci Adv 2019, 5, eaaw3192、Nat Commun 2023, 14, 8398、Nat Commun 2023, 14, 4505、Nat Commun 2022, 13, 4214、Nat Commun 2021, 12, 6399、Nat Commun 2019, 10, 5165、Nat Commun 2017, 8, 14537等期刊上。
过程工程所研究员魏炜,中国科学院院士、过程工程所研究员马光辉和北京大学第一医院崔一民教授为该论文的共同通讯作者。该工作得到了国家自然科学基金项目、北京自然科学基金等项目的支持。
论文链接:https://www.cell.com/cell-host-microbe/abstract/S1931-3128(24)00287-7
(生物剂型与生物材料研究部)
