基于细菌外膜囊泡的肿瘤免疫治疗体系研究取得新进展
肿瘤免疫治疗可通过激活人体自身免疫机能杀灭肿瘤细胞,具有十分广阔的应用前景,但肿瘤免疫抑制微环境已成为掣肘肿瘤免疫疗法发挥功效的关键问题。近日,过程工程所马光辉研究员和魏炜研究员团队发现了细菌天然分泌的单纯细菌外膜囊泡(OMVs)在调节肿瘤免疫抑制微环境中的巨大潜力,并采用仿生矿化策略使OMVs表面生长出“隐形”磷酸钙外壳,避免了单纯OMVs静脉注射带来的毒副作用。目前,已在小鼠体内展现出安全高效的肿瘤治疗效果。该体系还可整合靶向配体、光敏剂等不同功能分子,进一步提升对恶性肿瘤的治疗效果。相关工作发表于Advanced Materials上(DOI: https://doi.org/10.1002/adma.202002085)。
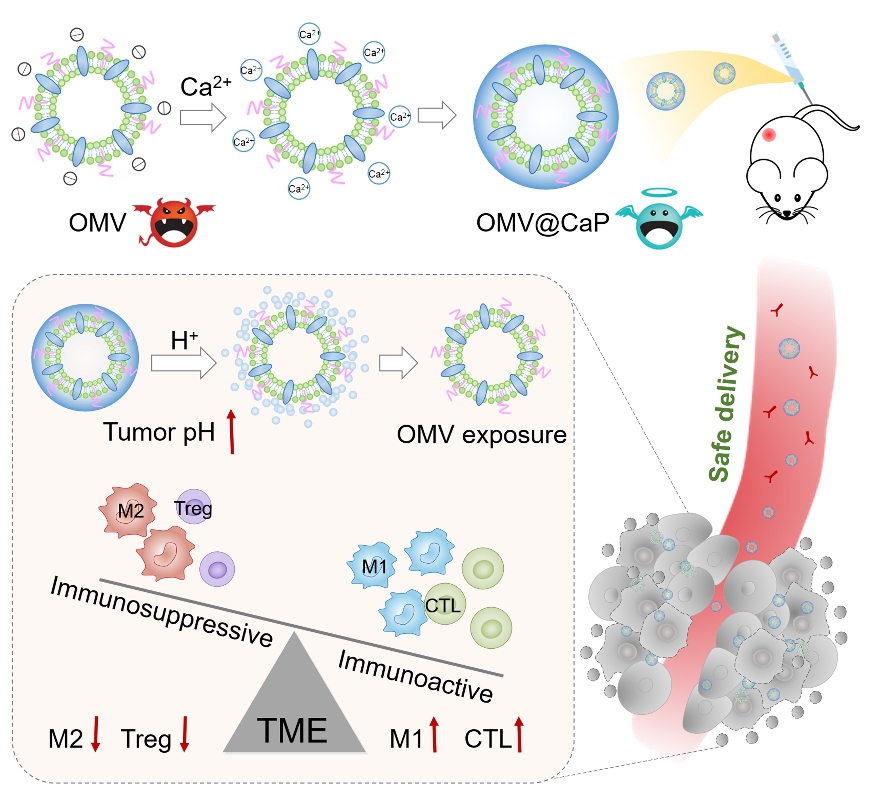
图 1 仿生矿化OMV的制备及其肿瘤微环境调节机制
利用纳米颗粒将免疫药物递送至肿瘤部位是改善肿瘤免疫抑制微环境的一种经典策略,但基于人工合成颗粒开发的免疫治疗体系仍存在着制备工艺复杂、药物装载率低、批次间重复性差等一系列难题。为此,马光辉研究员和魏炜研究员团队提出利用OMVs纳米颗粒作为肿瘤免疫治疗平台,无需人为添加免疫刺激药物,即可实现安全高效的肿瘤免疫微环境调控。
该团队首先在不同来源的OMVs中筛选到对肿瘤微环境改善能力最强的OMVE.coli(BL21),并以此构建肿瘤免疫治疗体系。为避免单纯OMV直接静脉注射带来的细胞因子风暴和抗体特异性清除等毒副作用,进一步通过仿生矿化的方法,使裸露的OMVs表面生长出生物安全性好的磷酸钙“隐形外壳”,以此屏蔽OMVs的危险信号及抗体识别位点,增加体系的安全性并延长其体内循环时间。当矿化颗粒借助纳米粒径到达肿瘤后,肿瘤部位的微酸环境使得磷酸钙外壳溶解,暴露的OMVs通过促进细胞毒性T细胞的浸润及M2型巨噬细胞向M1型的极化,有效改善肿瘤免疫抑制的微环境;同时,磷酸钙外壳溶解中和了微环境中的H+,酸性微环境的改善又可进一步促进M2型巨噬细胞向M1型极化。上述协同作用瓦解了肿瘤免疫抑制微环境,增强了免疫细胞的杀伤功能,可有效抑制肿瘤的生长。此外,该仿生矿化策略还能实现多种功能分子与矿化颗粒的有机结合,以此制备的添加了肿瘤靶向配体叶酸的矿化颗粒,以及添加了光敏剂吲哚菁绿(Indocyanine green, ICG)的矿化颗粒可分别实现治疗体系的主动靶向功能或光热免疫联合治疗,从而进一步提升对恶性肿瘤的治疗效果。

图 2 仿生矿化颗粒表征及其抗肿瘤效果。(a)OMV及矿化颗粒的透射电镜图(标尺:100nm);(b)矿化颗粒的元素分布(标尺:100nm);(c)小鼠组织代表性多光谱成像图片及其对应的pH值统计;(d)肿瘤组织的多色免疫荧光染色(标尺:200μm);(e)瘤内M1/M2及CD8/Treg比值;(f)各治疗组小鼠生存曲线及生存时间。
基于纳微颗粒的免疫治疗体系为免疫治疗新剂型的开发做出了重要贡献,过程工程所生化工程国家重点实验室生物剂型与生物材料团队的马光辉研究员和魏炜研究员对纳微颗粒进行了一系列深入研究,发现和创制了一系列纳微颗粒新剂型,成功用于肿瘤、乙肝、流感等重大疾病或传染病的免疫预防和治疗,部分剂型已通过伦理批准进入临床前和临床研究,相关工作相继发表于Nat Mater 2018, 17, 187、Nat Biomed Eng(DOI :10.1038/s41551-020-00624-6)、Nat Commun 2017, 8, 14537、Sci Adv 2020, 6, eaay7735、Adv Mater 2018, 31, 1801067、Adv Sci 2017, 4, 1700083、ACS Cent Sci 2019, 5, 796等期刊上。
过程工程所博士生卿爽为本文第一作者,马光辉研究员和魏炜研究员为共同通讯作者。该工作得到了国家自然科学基金群体项目、国家重点研发计划项目和中科院战略先导科技专项的支持。
(生物剂型与生物材料研究部)
