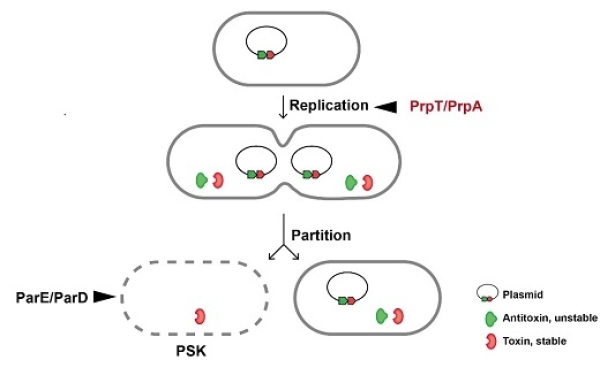
【南海海洋研究所】南海海洋所揭示质粒上毒素抗毒素系统新功能文章来源:南海海洋研究所 近日,中国科学院南海海洋研究所研究员王晓雪团队在《美国科学院院刊》(PNAS)上,在线发表了题为《接合型质粒编码的毒素/抗毒素系统PrpT/PrpA直接调控质粒拷贝数》的论文,系统阐述了质粒编码的毒素/抗毒素系统调控质粒复制功能的发现和作用机制。 质粒是存在于细菌染色体之外,具有独立复制能力的遗传元件。接合型质粒除编码复制、分配和接合转移系统外,往往携带毒力基因和抗性基因。接合型质粒介导的水平基因转移是细菌耐药性(包括碳青霉烯、多粘菌素等)快速扩散的重要途径。这些质粒能够在不存在抗生素的环境里依然稳定存在于细菌中,并进一步介导抗性基因的传播。因此,接合型质粒的稳定性机制是临床感染研究中关注的热点。 毒素/抗毒素系统(Toxin/Antitoxin System, TA)是较早发现具有稳定质粒功能的二元系统。TA系统在1983年发现存在于接合型质粒上,在功能上被认为通过“分离后致死效应“(Post-segregational killing, PSK)来维持质粒的稳定性。在PSK理论中,当质粒在细胞分裂过程中由于复制或分离错误发生丢失时,在不含质粒的子代细胞中,相对稳定的毒素蛋白会由于失去抗毒素的中和作用,发挥出毒性抑制细胞的分裂或直接杀死细胞,达到在群体中维持质粒稳定存在的目的。ParDE系统是较早支持PSK理论的研究模型之一。随着基因组测序技术的发展,大规模的临床和环境微生物基因组分析发现接合型质粒上富集大量TA系统。2000年,新西兰坎特伯雷大学教授Heinemann研究团队在PNAS的文章中提出了PSK理论的不足,认为质粒上TA系统的富集是质粒与质粒间竞争的结果,并非是通过PSK机制实现的。PSK理论很容易通过在模式细菌中异源表达TA来证实,因此一直被广泛用来作为解释质粒上富集TA系统的理论基础,但仅用异源表达的手段来研究TA的功能存在局限性,容易忽视TA系统的多样性生物学功能。 王晓雪团队研究发现,海洋细菌中携带一个接合型质粒,能够稳定存在并保持1个拷贝/细胞。为进一步研究质粒的稳定机制,科研人员对质粒上编码基因进行了功能研究。研究发现,这个质粒编码一对II型TA系统PrpT/PrpA,其中PrpT是ParE类家族毒素,而PrpA是功能未知的新颖抗毒素,然而,敲除prpA-prpT后,质粒的稳定性并没有受影响,质粒的拷贝数出现显著的异常升高,基因回补实验证实了这一点。在机制方面,抗毒素PrpA直接调控了质粒的拷贝数,并且直接结合质粒复制起始区上的重复子序列(iterons),以浓度依赖的方式竞争性地阻碍质粒复制蛋白RepB对复制起始区的结合,避免质粒的过度复制。 研究表明,抗毒素蛋白与质粒的复制蛋白共同维持质粒的低拷贝数,并与敲除TA后质粒出现高拷贝的表型一致。与PSK理论强调的TA系统在质粒分离后发挥作用不同,研究证实了TA系统可直接参与质粒的复制过程,是质粒上TA系统的新功能。对IMG数据库的TA系统进行比对研究,这一类TA系统的丰度明显高于ParDE系统,并且参与PrpA抗毒素调控质粒复制的结构域在临床耐药菌的质粒上广泛存在。结合研究可推测,细菌和古菌中广泛分布的TA系统通过多种途径发挥多样的生物学功能。 王晓雪团队博士尼松伟和李百元为论文共同第一作者,王晓雪和副研究员王鹏霞为论文共同通讯作者。研究工作得到国家杰出青年科学基金,国家自然科学基金委水圈微生物重大研究计划重点项目、面上项目,国家重点研发计划以及中科院青年创新促进会等的资助。 PrpT/PrpA调控质粒的复制 附件:
|